
Studie opzetten
DiaPregNL Cohort
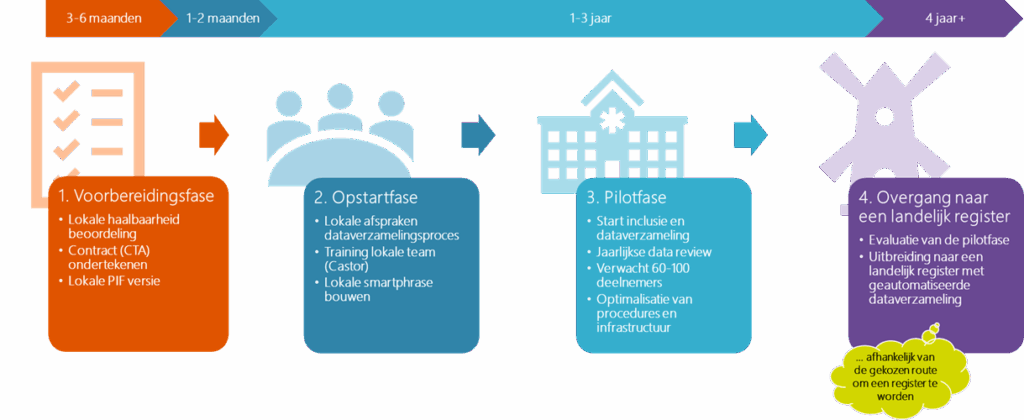
Samenvatting verantwoordelijkheden van deelnemende centra:
- Communicatie met coördinerend team bij vragen of knelpunten. Deelname aan feedbackrondes en pilotmeetings.
- Regelen van lokale ethische goedkeuring en ondertekening van de CTA.
- Lokale werving van deelnemers. Veilig bewaren van ondertekende toestemmingsformulieren (PIFs). Bijhouden van een actueel ISF, inclusief een beveiligd lokaal sleutelbestand.
- Data verzamelen door het invoeren van gegevens in Castor eCRF en het verzenden van vragenlijsten. Bewaken van datakwaliteit en volledigheid binnen eigen centrum.
Hieronder vind je een uitgebreide uitleg van de belangrijkste stappen in elke fase.
Voorbereidingsfase
Wat houdt deze fase in?
Tijdens de voorbereidingsfase vinden drie stappen vaak tegelijkertijd plaats. Er wordt een lokale haalbaarheidsbeoordeling uitgevoerd om te checken of het onderzoek op de locatie praktisch uitvoerbaar is, het contract (CTA) wordt ondertekend om de samenwerking formeel vast te leggen, en er wordt een lokale versie van het PIF opgesteld zodat deelnemers goed geïnformeerd zijn over het onderzoek en hun rol daarin.
Lokale haalbaarheidsbeoordeling
Voor de uitvoering van het onderzoek is het essentieel dat elk ziekenhuis de lokale haalbaarheid en ethische aspecten beoordeelt. Hoewel er een nWMO-verklaring beschikbaar is, blijft het de verantwoordelijkheid van de locatie om te bepalen of het onderzoek passend is binnen hun specifieke context. Hier is een zipbestand met alle documenten die nodig zijn voor de LHC. Vaak maakt de beoordeling ook de review en ondertekening van het contract (CTA) onderdeel uit van dit proces.
Dit proces is zeer locatieafhankelijk: In sommige ziekenhuizen gebeurt dit via de LHC (Lokale Haalbaarheid Commissie), al dan niet ondersteund door een researchmanagerplatform of researchcoördinatoren. Andere ziekenhuizen hebben geen LHC, maar bieden begeleiding via een researchcoördinator om te bepalen welke stappen nodig zijn.
We raden aan om contact op te nemen met de lokale researchcoördinator of toetsingscommissie om te bepalen welke procedure in jouw instelling van toepassing is. De coördinerend onderzoeker kan hierbij worden betrokken, bij voorkeur door een directe introductie via e-mail (in CC) met het lokale toetsingscommissie of de researchcoördinator.
Clinical Trial Agreement (CTA)
De pilotstudie wordt uitgevoerd onder een Clinical Trial Agreement (CTA) tussen Amsterdam UMC en een deelnemend centrum. Elk centrum dient de CTA te beoordelen en te ondertekenen. We vragen om één Principal Investigator (PI) per centrum te vermelden op de CTA. De overige betrokkenen zullen deel uitmaken van het lokale onderzoeksteam.
Dataverzamelingsproces
In het pilotfase functioneert DiaPregNL Register als een observationele cohortstudie. De deelnemende centra voeren de studie lokaal uit onder leiding van een lokale hoofdonderzoeker (PI). Elk PI stelt een lokale onderzoeksteam samen dat verantwoordelijk is voor de uitvoering van de studie op locatie.
Het lokale team informeert deelnemers, verkrijgt schriftelijke toestemming en verzamelt gegevens tijdens reguliere zorgcontacten.
Gegevens worden verzameld in Castor eCRF en aangevuld met digitale vragenlijsten die de deelnemer zelf invult. Papieren toestemmingsformulieren blijven voorlopig lokaal bewaard.
Verwacht aantal deelnemers
We verwachten dat elk centrum gedurende de pilotstudie ongeveer 20 deelnemers per jaar aanlevert, op basis van een schatting van 800 zwangeren met preexistente diabetes (PGDM) jaarlijks.
Dit betekent dat voor de duur van de pilot we ongeveer 60 deelnemers per centrum verwachten. Het exacte verwachte aantal deelnemers per centrum kan verder gespecificeerd worden tijdens de ondertekening van de CTA.
Patiënteninformatiebrief en toestemmingformulier (PIF)
Voor deelname aan de pilotstudie wordt gebruikgemaakt van een standaard patiënteninformatiebrief en toestemmingsformulier (PIF), opgesteld door het coördinerend centrum. Deze PIF is geschreven met het oog op de toekomstige uitbreiding naar een landelijk kwaliteitsregister en goedgekeurd door METC van het Amsterdam UMC. PIF is beschikbaar in Nederlands en Engels.
Wat als de PIF lokaal moet worden aangepast?
Lokale medisch-ethische commissies of toetsingscommissies vragen soms om aanpassingen in de formulering van de PIF. Dit is uiteraard toegestaan, mits de essentie van de toestemming behouden blijft. Als een centrum kiest om bepaalde aspecten niet op te nemen, kunnen er problemen ontstaan bij de overgang naar het register, omdat de deelnemer dan niet automatisch kan worden opgenomen in het toekomstige kwaliteitsregister. We vragen u om ons op de hoogte te houden van alle wijzigingen, zodat we tijdig kunnen reageren en afstemmen waar nodig.
Is er vergoeding?
Deelnemers ontvangen geen financiële vergoeding voor hun deelname aan het onderzoek, wat ook wordt uitgelegd in het Patient Information Form.
Pilotcentra ontvangen eveneens geen financiële vergoeding. We waarderen de inzet van de centra, vooral in deze belangrijke pilotfase. Als erkenning voor hun bijdrage wordt elk deelnemend ziekenhuis uitgenodigd om één vertegenwoordiger van de interne geneeskunde en één vertegenwoordiger van de gynaecologie afdeling op de auteurslijst te plaatsen. We vertrouwen erop dat elk centrum de vertegenwoordigers kiest die het beste de bijdragen van hun team weerspiegelen. Publicatie wordt geregeld door het coördinerende centrum, met een nadruk op hoog geïndexeerde tijdschriften en open access publicaties.
Tijdsinvestering in de pilotfase
We begrijpen dat tijdsinvestering een belangrijke overweging is. De exacte tijdsinspanning per deelnemer is nog niet definitief, aangezien de eCRF in Castor momenteel nog wordt getest. Voorlopig gaan we uit van max. 5 minuten per meetmoment (totaal 20 minuten per deelnemer verdeeld over alle meetmomenten). Daarnaast delen we een dataverzameling smartphrase template om de documentatie in EPD te versnellen.
Opstartfase
Wat houdt deze fase in?
De opstartfase begint zodra de lokale goedkeuring is verkregen en het contract (CTA) door beide partijen is ondertekend.
Tijdens het opstartoverleg met de coördinerend onderzoeker worden alle praktische afspraken voor de uitvoering van het onderzoek besproken, zoals de werkwijze voor dataverzameling, de onderzoeksprocedure en de inrichting van het ISF. Ook worden afspraken gemaakt over de fysieke opslag van de PIF’s. Daarnaast krijgt het lokale team training in het gebruik van Castor, en wordt een lokale smartphrase opgesteld zodat standaardteksten in het patiëntendossier eenvoudig en consistent kunnen worden gebruikt.
Castor eCRF
In deze studie gebruiken we Castor electronic Case Report Form (eCRF), een veilig online platform voor het verzamelen en beheren van onderzoeksgegevens. Het is gebruiksvriendelijk, waardoor training niet nodig is. Vanwege de gevoelige gegevens is het belangrijk om twee-factor-authenticatie (2FA) in te schakelen; zonder 2FA heb je geen toegang tot de studieomgeving. Tijdens de opstartmeeting met de coördinerend onderzoeker wordt een korte demo gegeven over het correct invullen van de eCRF.
Elk centrum krijgt toegang tot twee locaties binnen de studieomgeving: hun eigen ziekenhuis, waar ze echte patiëntgegevens invoeren, en een testlocatie, die gebruikt kan worden om formulieren en datainvoer te oefenen. Hoewel de eCRF grondig is getest, kunnen er tijdens het invoeren van gegevens nog fouten optreden. Deze dienen te worden doorgegeven aan de coördinerend onderzoeker. Data wordt verzameld voor onderzoek in twee aparte studieomgevingen:
- DiaPregNL Register: bevat gepseudonimiseerde onderzoeksdata uit de deelnemende centra, bijvoorbeeld over diabeteszorg tijdens de zwangerschap.
- Koppel DiaPregNL: bevat persoonlijke data van deelnemers die expliciet toestemming hebben gegeven, gescheiden van de data in het DiaPregNL Register.
Deelnemers moeten toestemming geven voor het gebruik van hun gegevens, die strikt beveiligd worden opgeslagen en beheerd, volgens de AVG-richtlijnen. De gegevens worden verzameld door het interne geneeskunde-team. We vragen van pilot centra om feedback te geven die we kunnen gebruiken om het systeem te verbeteren voordat het nationale register wordt gelanceerd, wat binnen drie jaar gepland is.
Investigator Site File (ISF)
Elke site dient een lokale ISF bij te houden, bij voorkeur als een map op een gedeelte, beveiligde netwerk. Dit map bevat het Lokale Sleutelbestand, met de persoonlijke data van deelnemers, en alle relevante studiedocumentatie (zoals het protocol, PIFs, en ondertekende CTA). Het bestand dient veilig te worden opgeslagen en is uitsluitend toegankelijk voor bevoegde medewerkers.
Fysieke Opslag van PIF’s
De deelnemende ziekenhuizen dienen gedurende de pilotfase fysieke versie van de ondertekende patiënteninformatiebrief en toestemmingformulier veilig te bewaren.
Na de pilotfase kunnen de PIF’s mogelijk naar Amsterdam UMC worden overgebracht, maar het langetermijnplan voor opslag is nog in ontwikkeling en wordt later gecommuniceerd.
Smartphrase
Tijdens standaard poli afspraken kan een smartphrase worden gebruikt om de gegevens die nodig zijn voor het onderzoek consistent te noteren. Dit bespaart tijd, omdat alle benodigde informatie op één plek staat in de notities, zolang de smartphrase volledig ingevuld wordt tijdens het patiëntcontact.
Hoewel de gegevens nog handmatig naar Castor overgedragen moeten worden, zorgt de smartphrase ervoor dat alle relevante informatie makkelijk toegankelijk is en het proces van gegevensinvoer sneller en efficiënter verloopt.
Dataverzameling volgens AVG
Wij hanteren strikt de richtlijnen van de Algemene Verordening Gegevensbescherming (AVG). We vragen elke deelnemer toestemming om hun gegevens te verzamelen en te delen met Amsterdam UMC voor het DiaPregNL Register, en we vragen een aparte toestemming voor het Koppel DiaPregNL.
We hebben een positief privacyadvies gekregen van de Functionaris Gegevensbescherming van Amsterdam UMC. Voor een overzicht van hoe de data binnen de studie stroomt, zie Figuur hieronder.
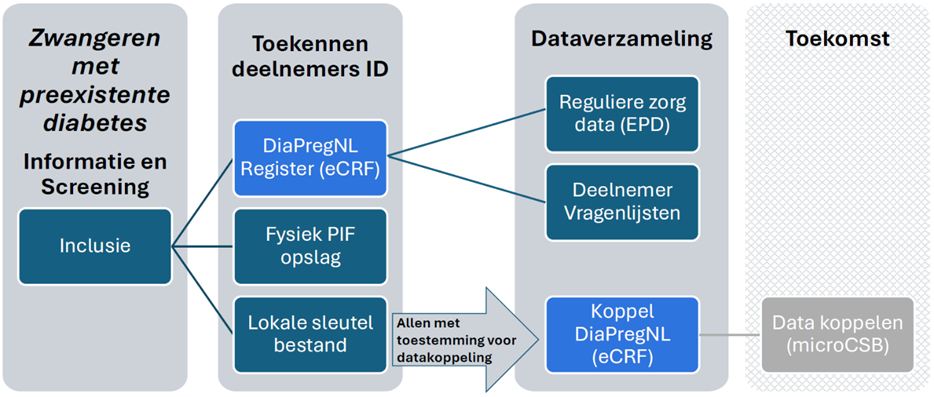
- Beveiliging bij de lokale centra: Een beveiligde locatie binnen het lokale computernetwerk is verplicht voor het ISF, dat gedeeld wordt met de coördinerend onderzoeker en het lokale onderzoeksteam. Het lokale sleutelbestand moet extra beveiligd worden (bijvoorbeeld met een wachtwoord en 2 Factor Authenticatie). Er dient een afgesloten kast beschikbaar te zijn voor de opslag van de ondertekende PIF’s.
- Pseudonimisering: De onderzoeksdata in het DiaPregNL Register worden zodanig verwerkt dat de identiteit van de deelnemers niet direct herleidbaar is zonder aanvullende informatie, welke apart wordt opgeslagen in het lokale sleutelbestand en in de Koppel DiaPregNL (voor deelnemers die toestemming hebben gegeven voor datakoppeling en delen met het coördinerend centrum).
- Beveiliging bij het coördinerend centrum: Beide registers worden beheerd in Castor eCRF en voldoen aan strikte beveiligingsprotocollen Alleen het coördinerende team en het lokale team kunnen de deelnemers van hun eigen ziekenhuis zien. Elk ziekenhuis ziet alleen zijn eigen deelnemers.. Binnen Amsterdam UMC is voor Castor geen DPIA vereist. Mocht de lokale haalbaarheidscommissie toch een DPIA vereisen, kunnen we samenwerken om deze op te zetten voor de lokale situatie.
Pilotfase
Wat houdt deze fase in?
De pilotfase start na het opstartoverleg met de coördinerend onderzoeker.
In deze fase begint de werving van deelnemers en de dataverzameling op de locatie. De voortgang en eerste ervaringen met het onderzoeksproces worden geëvalueerd na 3, 6 en 12 maanden, en er vindt jaarlijks een datareview plaats om de kwaliteit en volledigheid van de gegevens te beoordelen. Op basis van de evaluaties worden de procedures en infrastructuur waar nodig verder geoptimaliseerd.
Deze fase zal doorgaan totdat het onderzoek uitgroeit tot een officieel register, naar verwachting rond 2027. Meer over de stappen om een register te worden, is in de volgende sectie.
Werving en Inclusiecriteria
De werving vindt hoofdzakelijk plaats via de interne geneeskunde, maar gynaecologen kunnen ook patiënten informeren over het onderzoek. We hebben een website en een eenvoudige flyer die in de spreekkamers kan worden opgehangen.
We adviseren om mogelijke deelnemers tijdens de eerste afspraak in het eerste trimester toe te lichten en ze na de termijnecho te includeren. Inclusie op een later moment is mogelijk maar leidt tot minder complete data.
Inclusiecriteria
- Zwanger, in eerste trimester
- Volwassen (18+), wilsbekwaam
- DM diagnose voor zwangerschap
- Spreekt Nederlands of Engels*
*We hopen binnenkort PIF’s en vragenlijsten in meer talen beschikbaar te hebben.
Dataverzameling proces
De dataverzameling in de pilotstudie vindt plaats tijdens reguliere zorgcontacten met de deelnemende patiënten, zonder dat er extra studiebezoeken nodig zijn. Er zijn vier meetmomenten: één per trimester van de zwangerschap en één postpartum (Figuur 2). Alle verzamelde gegevens worden ingevoerd in het Castor eCRF.

Voordat we data automatisch kunnen verzamelen, hebben we een kortetermijnoplossing ontwikkeld. Om het invoeren van data te vereenvoudigen, is er een voorbeeld smartphrase gemaakt voor alle meetmomenten. Deze kan worden gebruikt tijdens standaardafspraken in de zwangerschap. Zo worden de basisgegevens die nodig zijn voor het register al tijdens de reguliere consulten verzameld en later in het DiaPregNL Register ingevoerd.
Diabetesbeheer
Het meest van de verzamelde data betreft diabetesbeheer en wordt verzameld door het team van interne geneeskunde tijdens reguliere spreekuren. Hierbij gaat het om informatie over glucosemonitoring, insuline(pomp)gebruik, medicatie en CGM-data (indien beschikbaar). De data worden viermaal verzameld: eenmaal per trimester en eenmaal postpartum.
Zwangerschapsuitkomsten
Momenteel vragen we het interne geneeskundeteam om de obstetrische voorgeschiedenis en zwangerschapscomplicaties in te vullen op basis van het dossier en de patiënte anamnese. We zijn ons ervan bewust dat dit niet de meest betrouwbare bron is en hopen voor het register data te verkrijgen via Perined of rechtstreeks uit het ziekenhuisinformatiesysteem. Als een ziekenhuis nauwer samenwerkt met het gynaecologieteam en het haalbaar is om de vragen door gynaecologen te laten invullen, bespreken we dit graag.
Afsluiten van een deelnemer
Elke deelnemer in de studie krijgt een status toegewezen wanneer de deelname wordt beëindigd, hetzij door voltooiing van de dataverzameling, hetzij door voortijdig stoppen of verlies van follow-up (zie Tabel hieronder). Het is belangrijk om de reden van afsluiting nauwkeurig vast te leggen in het Castor onderzoeksomgeving.
Voor elke afgesloten deelnemer wordt de datum van afsluiting vastgelegd. Indien mogelijk wordt aanvullende informatie over de reden voor afsluiting verzameld, met respect voor privacy en ethische richtlijnen. Deze gegevens worden gebruikt voor datakwaliteitscontrole, analyses van uitval en het correct interpreteren van de resultaten van de cohortstudie.

Gebruik van onderzoeksgegevens
Op dit moment mag alleen Amsterdam UMC van de verzamelde onderzoekgegevens gebruikmaken. De deelnemende ziekenhuizen kunnen gebruik maken van de eigen verzamelde onderzoeksgegevens, zoals vastgelegd in de Clinical Trial Agreement. In de PIF is al opgenomen dat gegevens in de toekomst mogelijk gedeeld kunnen worden met derde partijen, ook buiten de EER, maar dat is op dit moment nog niet van toepassing. Dergelijke datadeling zal pas mogelijk zijn zodra het project formeel wordt omgezet in een register. In dat geval zal er een aparte Joint Research Data Agreement worden opgesteld, die door alle deelnemende centra moet worden ondertekend. Onderdeel daarvan zal ook een toetsingscommissie zijn die aanvragen voor secundair gebruik van de onderzoeksgegevens beoordeelt. Eventuele wijzigingen in het gebruik of de structuur van het register zullen altijd vooraf worden afgestemd met en gecommuniceerd aan de lokale hoofdonderzoekers.
Overgang naar een landelijk register
Wat houdt deze fase in?
We onderzoeken momenteel verschillende opties om een officieel (kwaliteits)register te worden. Dit omvat onder andere het uitwerken van de juridische structuur, een veilige en duurzame aanpak voor gegevensbeheer, een bestuursmodel, IT-infrastructuur en een financieel plan voor de lange termijn.
De voorkeur gaat uit naar het opzetten van een zelfstandig register, maar we kijken ook naar aansluiting bij een bestaand register zoals DPARD of Perined, dat al over de benodigde infrastructuur beschikt. In alle scenario’s blijft de huidige pilotfase een belangrijke eerste stap. Daarom voeren we de pilot alvast uit terwijl we tegelijkertijd werken aan de verdere ontwikkeling van het register
Scenario’s automatisering dataverzameling
Automatisering van de dataverzameling is een complex proces, zowel op lokaal als nationaal niveau. Het uiteindelijke doel is om alle DiaPregNL data automatisch te verzamelen. Uit recente ervaring en gesprekken met experten, weten we echter dat de meeste ICT-afdelingen in ziekenhuizen niet de personeelscapaciteit hebben om de automatisatie van data-extractie voor onderzoeksprojecten te prioriteren, maar wel voor kwaliteitsregistraties. Het is dus mogelijk dat automatisering pas kan plaatsvinden zodra het DiaPregNL Register officieel erkend wordt als een verplicht (kwaliteits)register. Centra die ervaring hebben met automatisering en hier vanaf het begin aan willen werken, vragen we om aan ons door te geven wat ze van ons nodig hebben en hoe dit voor hen werkt.
Om een (kwaliteits)register te worden en daarmee automatisering van dataverzameling mogelijk te maken, zijn er drie scenario’s. Het eerste scenario is dat we ons eigen register worden, waarbij we vanaf het begin onze eigen infrastructuur moeten opbouwen en financiering moeten regelen. Dit biedt het voordeel dat de meeste details beschikbaar zijn en de mogelijkheid om gegevens te koppelen aan andere databronnen. Het nadeel is echter dat het extra werk vraagt en dat het opzetten van geautomatiseerde systemen per ziekenhuis tijdrovend en complex kan zijn. Het tweede scenario is aansluiten bij DPARD, het recent opgezet landelijke kwaliteitsregister voor diabeteszorg. Dit maakt gebruik van een bestaande infrastructuur, wat de implementatie vergemakkelijkt. Het nadeel is dat de data anoniem zijn, minder gedetailleerd, en dat koppelingen met andere databronnen beperkt of onzeker zijn. Het derde scenario is een patiënt-driven register, waarbij patiënten zelf hun gegevens invoeren of aanmelden. Dit scenario vraagt nauwelijks extra tijd van de zorgverleners, maar kan leiden tot introductie van bias en onzekerheden over de betrouwbaarheid en volledigheid van de gegevens.
CTA vs JRDA
Voor de pilotstudie gebruiken we een Clinical Trial Agreement (CTA) als juridische basis voor de samenwerking tussen Amsterdam UMC en de deelnemende ziekenhuizen. In deze overeenkomst is vastgelegd dat ieder centrum alleen toegang heeft tot de eigen verzamelde onderzoeksgegevens en dat het delen van gegevens met andere partijen niet is toegestaan.
Als we besluiten het project om te zetten naar een onafhankelijk (kwaliteits)register, zal er een aparte Joint Research Data Agreement (JRDA) worden opgesteld. Deze nieuwe overeenkomst – die ook al wordt genoemd in de CTA – moet dan opnieuw worden ondertekend door alle betrokken centra. In de JRDA worden afspraken vastgelegd over gezamenlijk databeheer, het eventueel delen van data voor aanvullend wetenschappelijk onderzoek, en de rol van een onafhankelijke commissie die dataverzoeken beoordeelt. Pas na ondertekening van de JRDA is datagebruik buiten het eigen centrum mogelijk.
